Determinación de sulfatos

Sesión 6 Práctica 8
¡Volvemos con la última
práctica del trimestre! Y la más compleja para mi forma de verlo. Esta vez a
diferencia de las demás prácticas, vamos a juntar el preparar disoluciones
(disoluciones seriadas a varias concentraciones) y el uso de un aparato nuevo,
por lo que es como una doble práctica a la vez pero si os interesa aprender
seguro que paso a paso lo vamos consiguiendo, intentaré dar todos los detalles
posibles para que quede bien explicado y si sale bien ¡pareceremos hasta
profesionales! ¡A ponernos la bata!
Objetivos
Aprender a usar el
espectrofotómetro
Preparar una resta de
calibrado con la absorbancia a 650 nm
Preparar disolución matriz de
BaCl2 y H2SO4
Analizar 2 muestras de agua
con el espectrofotómetro
Fundamento
Realizar con unas
disoluciones seriadas creadas a partir de BaCl2 y H2SO4 para que se cree una
turbidez en el agua, en la que de la primera a la última vaya tornando más
opaca con la finalidad de conseguir en el espectrofotómetro con diversas
muestras a diferentes concentraciones una tabla de absorbancia con la que
después, hallando las concentraciones, conseguir hacer una recta de calibrado
Materiales
2 vasos de precipitado
3 pipetas de 10ml
Cristal de reloj
Pipeteador
Embudo
Probeta
Papel secante para limpiar
Reactivo
HSO4 0,2 N
BaCl2 0,0962 N
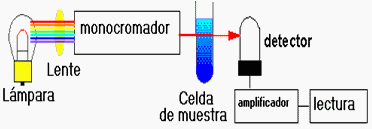
Aparato
Espectrofotómetro

Procedimiento
1. Se realiza
la preparación de la disolución madre de BaCl2 0,0962 N y disolución madre de
HSO4 0,2 N necesarias para realizar las
muestras
2.Se toman 6 tubos de ensayos
en una gradilla y se enumeran para evitar errores a la hora de la medición
3.Añadimos en el primer tubo
6ml de H2O destilada, la cual nos servirá para el calibrado o el cálculo blanco
4.Procedemos a realizar las
muestras restantes a diferentes concentraciones y por último 6 ml de HSO4
5.También realizamos dos
tubos en las que añadimos el agua de muestra
6.Cuando tenemos todas las
muestras para medir, procedemos a ir al espectrofotómetro
7.El espectrofotómetro se
enciende y deja un rato para que realice los procesos de autocalibrado
8.Se ponen las muestras
anteriormente realizadas siempre con la primera de medición en blanco y luego
en orden aparente de turbidez que presenten, para intentar lo mínimo posible
contaminar las demás mediciones
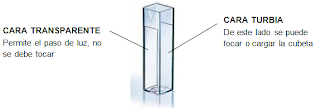
9.Comenzamos la parte del
proceso del espectrofotómetro. Cogemos las celdas donde vamos a verter nuestras
muestras, tienen forma rectangular y dos texturas diferentes para dar mejor
resultado. Una parte lisa y otra rugosa. Limpiamos bien las celdas para no
tener problema con su transparencia, y un dato importante es que hay que coger
la celda en todo momento por su parte rugosa, para no dejar marcas en la parte
lisa y afecte al resultado
10.Como vamos a medir la
absorbancia a 650nm ponemos esa capacidad en la longitud de onda antes de
empezar a medir
11. Ponemos la primera
muestra, el agua destilada. Cuando salga el dato de absorbancia taramos con el
botón AUTOCERO, ya que el agua destilada era nuestra medida de referencia.
Todas las muestras dentro de la celda tiene que estar en una capacidad superior
a tres cuartas partes del volumen para que se capte bien la medición
12.Realizamos a las
siguientes muestras lo mismo, siempre de menor concentración de H2SO4. Cada vez
que realizamos una medición limpiamos bien la celda para evitar que se mezclen
concentraciones, para limpiarlas debemos tener un papel secante y boca abajo la
celda ponerla encima del papel y agitar
13.Importante remover o
agitar todas las muestras para que detecte mejor el espectrofotómetro mejor las
partículas en suspensión
14.Introducir cada celda en
la ranura con la parte rugosa hacia nosotros, dejando la parte lisa mirando
hacia el haz de luz
15.Cuando terminemos todas
las mediciones, limpiamos muy bien las celdas, es importante porque es
necesario que siempre estén en un estado óptimo para la siguiente medición
16.Por último calculamos las
concentraciones teniendo ya la absorbancia, con ella creamos la recta de
calibrado y si es necesario la recta de regresión
Medidas de prevención
Es bueno que cuando tengamos los tubos de ensayo en la gradilla vayamos separando los que ya hemos medido de los que no para evitar medir dos veces un mismo tubo por despiste
Importante numerar y enunciar en en cada disolución realizada que contiene, debemos saber en todo momento que es lo que contiene cada muestra
Resultados
H2SO4 0,2 N 100ml
BaCl2 0,0962 N 100ml
Para calcular las concentraciones usamos la formula
Vi(Volumen inicial) · Ci (Concentración inicial) = Vf (V. Final) · Cf (C. Final)
Cuando hayamos las concentraciones a partir de la abundancia obtenemos:
Del tubo 2: 0,15 mg/L
Del tubo 3: 0,11 mg/L
Del tubo 4: 0,06 mg/L
Del tubo 5: 0,03 mg/L
Recordemos que del tubo 1 no tenemos concentración porque es solo agua destilada para calcular el blanco (Tarar) y el tubo 6 no tiene BaCl2 solo, por lo que no podemos hallar la concentración de sulfúrico
Para calcular las concentraciones usamos la formula
Vi(Volumen inicial) · Ci (Concentración inicial) = Vf (V. Final) · Cf (C. Final)
Cuando hayamos las concentraciones a partir de la abundancia obtenemos:
Del tubo 2: 0,15 mg/L
Del tubo 3: 0,11 mg/L
Del tubo 4: 0,06 mg/L
Del tubo 5: 0,03 mg/L
Recordemos que del tubo 1 no tenemos concentración porque es solo agua destilada para calcular el blanco (Tarar) y el tubo 6 no tiene BaCl2 solo, por lo que no podemos hallar la concentración de sulfúrico
No hay comentarios:
Publicar un comentario